Gas Ideal
- Pengertian Gas Ideal
Gas yang ditinjau dalam pembahasan ini adalah gas ideal, yaitu suatu gas yang memiliki sifat-sifat sebagai berikut:
- Gas ideal terdiri atas partikel-partikel (atom atau molekul) dengan jumlah yang banyak sekali dan antar partikel tidak terjadi gaya tarik-menarik (interaksi).
- Setiap partikel gas itu tersebar merata dan bergerak secara acak.
- Jarak antar partikel jauh lebih besar daripada ukuran partikel.
- Setiap tumbukan yang terjadi antar partikel berlangsung secara lenting sempurna dalam waktu yang singkat.
- Tidak ada gaya antara partikel yang satu dengan partikel yang lain, kecuali bila kedua buah partikel tersebut bertumbukan.
- Berlaku Hukum Newton tentang gerak.
1. Gambaran Gas Ideal
Sumber: Buku Kimia SMK
- Persamaan Keadaan Gas Ideal
- Hukum Boyle-Gay Lussac
Gas dalam suatu ruang tertutup, keadaannya ditentukan oleh volume, tekanan, dan suhu gas tersebut. Menurut hukum Boyle-Gay Lussac, tekanan(p), volume(v),dan suhu mutlak(T) dari gas ideal memenuhi hubungan:..................................... 1.1
dengan :
p = tekanan gas
V = volume gas
n = jumlah mol gas
R = tetapan umum gas = 8314 J/kmol.K atau 8,31 J/mol.K
T = suhu mutlak (K)
b. Hubungan Jumlah Mol dengan Massa Total dan Jumlah Partikel
Misalkan massa total gas= m dan jumlah partikel gas= M, maka jumlah mol gas(n) dapat dinyatakan:
Misalkan massa total gas= m dan jumlah partikel gas= M, maka jumlah mol gas(n) dapat dinyatakan:
Atau
dengan :
m = massa total gas
M = massa relatif partikel (atom atau molekul) gas
N = bilangan Avogadro= 6,02 x 1023 partikel/mol
Bila persamaan (1.2) dimasukkan ke persamaan (1.1), maka akan diperoleh persamaan keadaan gas berikut
: ....................................... 1.4
....................................... 1.4
dengan memasukkan persamaan (1.3) ke persamaan (1.1) dapat juga diperoleh persamaan gas bentuk lain, yaitu:
N = jumlah partikel gas
No = bilangan Avogadro = 6,02 x 1023 partikel/mol
k = tetapan Boltzman

- Teori Kinetik Gas Ideal
- Tekanan Gas dalam Ruang Tertutup
Perubahan momentum gas dapat dinyatakan sebesar :
p = momentum akhir – momentum awal
p = -m0vx – m0vx = -2m0vx
Selang waktu untuk perjalanan dapat dihitung dengan :

Sumber: Buku Kimia SMK
Wadah berbentuk kubus berisi partikel-partikel gas yang bergerak secara
acak. Sebuah molekul dengan komponen vx menumbuk dinding secara elastis sehingga mengubah tanda vx menjadi negatif, sedangkan tanda vy dan vz tidak berubah.
Laju perubahan momentum molekul pada suatu dinding yang sama sesuai dengan hukum kedua Newton tidak lain adalah gaya, yaitu:
Tekanan p adalah per satuan luas, sehingga:
Jika ada sejumlah N molekul gas dalam wadah tertutup dengan komponen kecepatan pada
sumbu x adalah v1x, v2x, …,vNx, tekanan total gas pada suatu dinding adalah
karena nilai rata-rata  ,dan volume wadah V = d3 , maka dapat ditulis:
,dan volume wadah V = d3 , maka dapat ditulis:
Kuardat kelajuan setiap molekul gas adalah
Sesuai dengan anggapan bahwa setiap molekul bergerak ke segala arah secara acak dengan
kelajuan tetap, maka rata-rata kuardat kecepatan pada arah x, y , dan z adalah sama besar, Sehingga:
Jika nilai 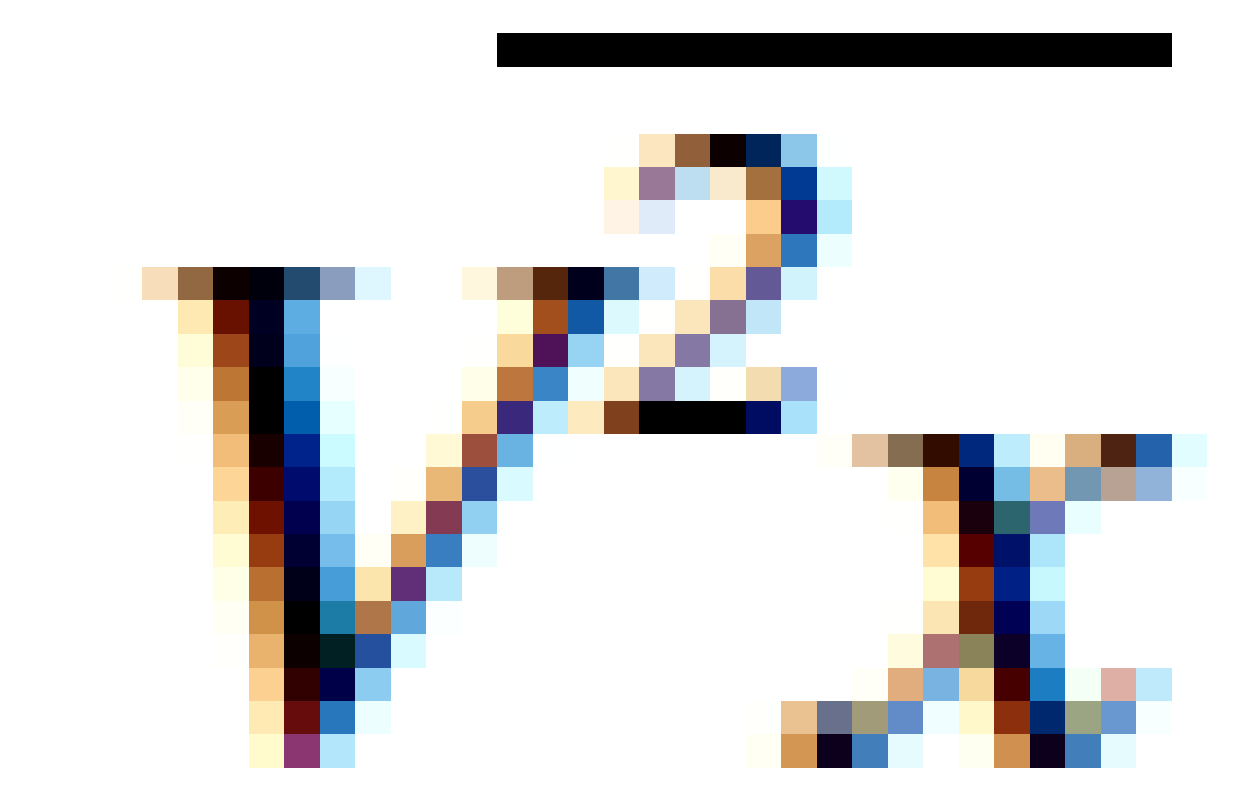 dapat dimasukkan ke persamaan tekanan, sehingga:
dapat dimasukkan ke persamaan tekanan, sehingga:
dengan
p = tekanan gas (Pa)
m0 = massa sebuah partikel (molekul) gas (kg)
v2 = rata-rata kuardat kecepatan (m2/s2)
N = banyak molekul (partikel) gas (butir)
V = volume gas (m3)
Selain itu, besar 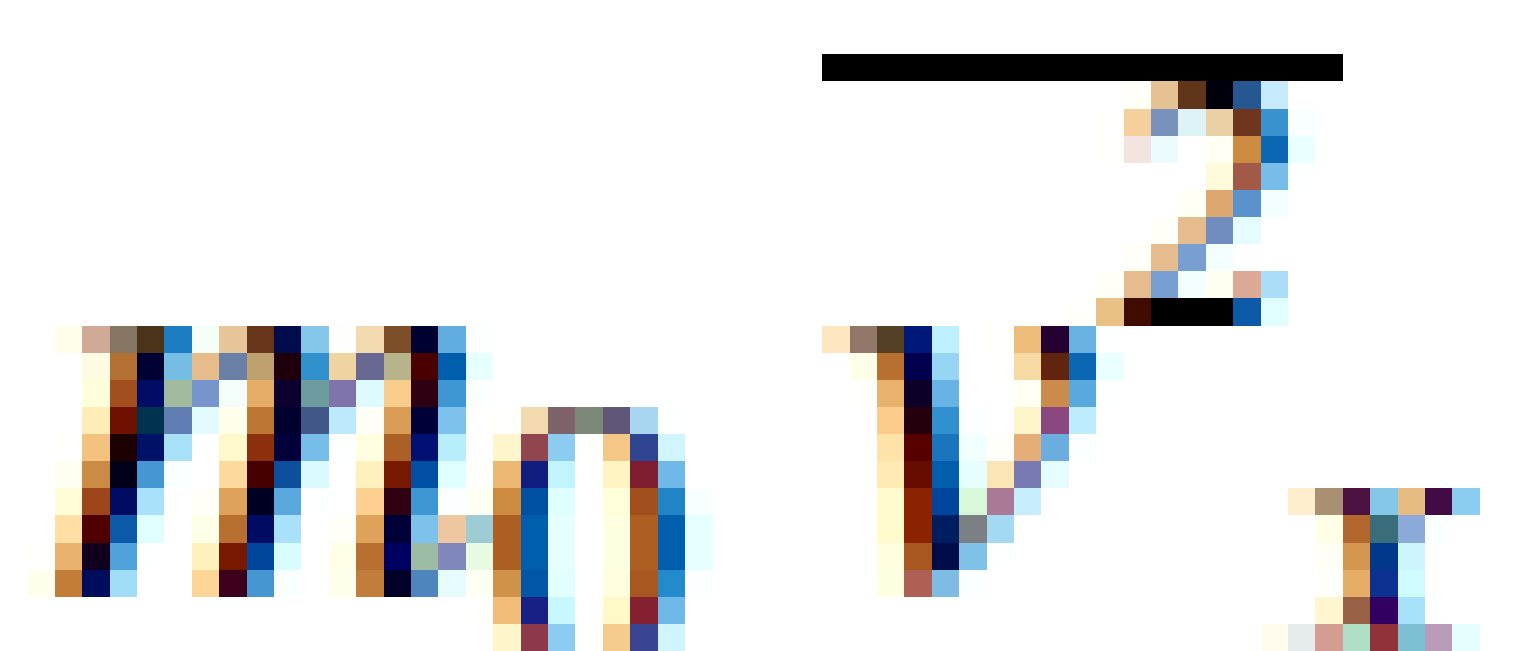 bisa diganti dengan
bisa diganti dengan sehingga
sehingga
dengan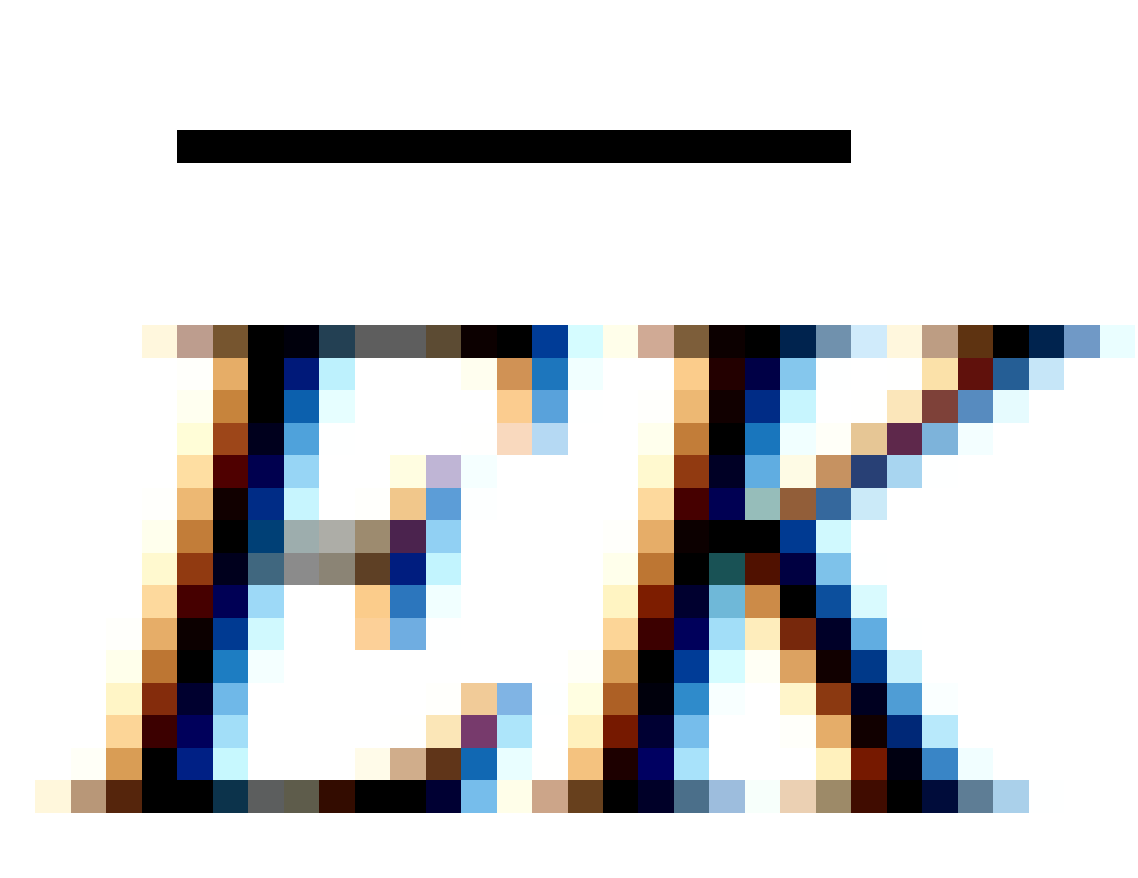 adalah energi kinetik rata-rata satu partikel gas.
adalah energi kinetik rata-rata satu partikel gas.
- Suhu Gas Ideal
Perhatikan persamaan berikut
Sesuai dengan persamaan keadaan gas ideal, 
dengan yang disebut tetapan Boltzman. Karena
yang disebut tetapan Boltzman. Karena 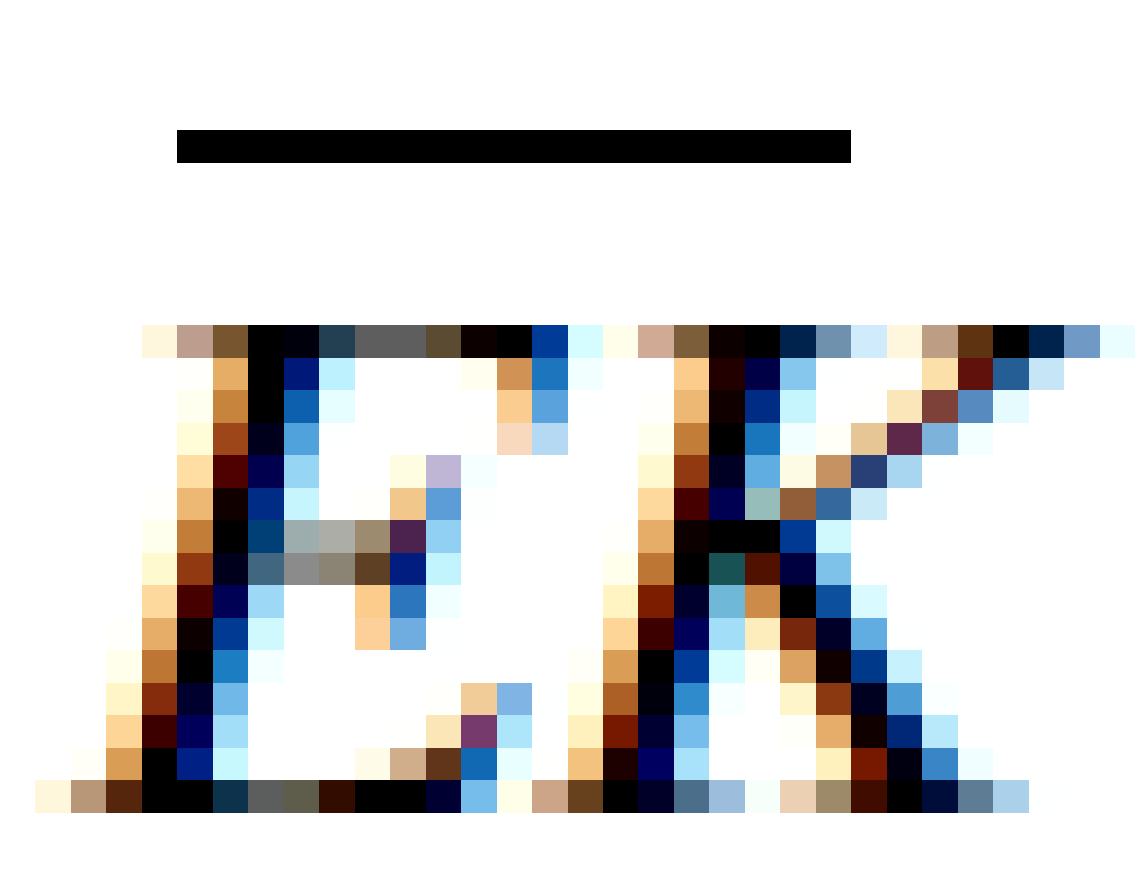 adalah energi kinetik translasi rata-rata per molekul, maka suhu merupakan suatu ukuran dari energi kinetik molekul.
adalah energi kinetik translasi rata-rata per molekul, maka suhu merupakan suatu ukuran dari energi kinetik molekul.
- Kecepatan efektif gas ideal
Rata-rata kuardat kecepatan partikel gas 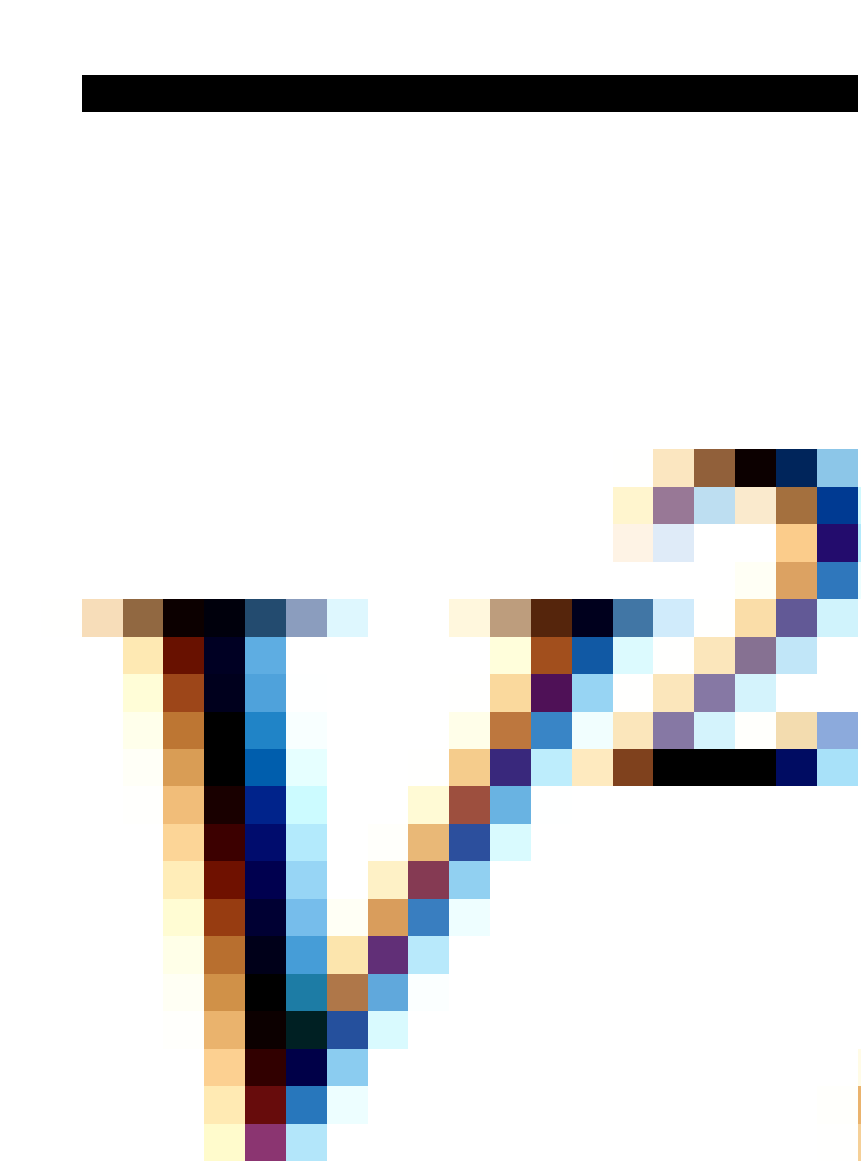 dapat dinyatakan sebagai berikut
dapat dinyatakan sebagai berikut
Kecepatan efektif Vrms (rms= root mean square) didefinisikan sebagai akar rata-rata kuadrat kecepatan dengan rumus:
Dengan menyatakan  maka akan terbentuk persamaan,
maka akan terbentuk persamaan,
Karena jumlah mol gas, n = atau
atau 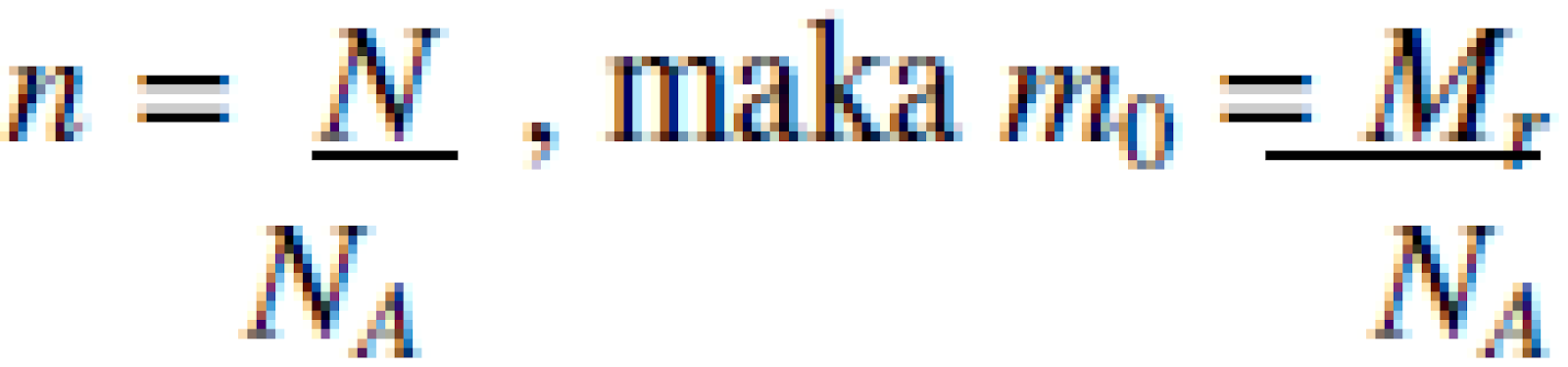
Persamaan diatas menyatakan bahwa pada suhu tertentu, molekul-molekul gas yang lebih ringan secara rata-rata akan bergerak lebih cepat daripada molekul-molekul gas yang lebih berat. Atau, pada suhu tertentu kecepatan efektif molekul gas berbanding terbalik dengan akar massa molekul relatifnya.Selain itu,  dan dengan menyatakan Nm0 = massa total gas (m), maka:
dan dengan menyatakan Nm0 = massa total gas (m), maka:
Persamaan diatas menyatakan hubungan kecepatan efektif gas dengan tekananya. Akan tetapi harus diperhatikan bahwa untuk gas, perubahan tekan
an p berkaitan dengan perubahan massa jenis karena massa jenis bergantung pada volume. Sebagai akibat dari hukum Boyle, maka diperoleh bahwa p berbanding lurus dengan V. Dengan demikian, kecepatan efektif gas tidak tergantung pada tekanan atau volume gas.
- Teorema Ekipartisi Energi
Molekul hanya melakukan gerak translasi memiliki tiga derajat kebebasan. Mekanika statistik menunjukkan bahwa untuk sejumlah besar partikel yang memenuhi hukum mekanika Newton»klasik, energi yang tersedia terbagi merata pada semua derajat kebebasan. Hal ini dinyatakan dengan Teorema Ekipartisi Energi, yang berbunyi “Untuk suatu sistem molekul-molekul gas pada suhu mutlak T dengan setiap molekul memiliki f derajat kebebasan (degree of freedom), energi mekanik rata-rata per molekul EM atau energi kinetik rata-rata permolekul EK adalah:  ”
”
- Derajat Kebebasan Molekul Gas Diatomik
Gas diatomik memiliki 3 derajat kebebasan untuk gerak translasi. Sedangkan untuk gerak rotasi hanya memiliki 2 derajat kebebasan, termasuk gerak vibrasi molekul juga memiliki 2 derajat kebebasan.
Sumber: Buku Fisika SMA Kelas 2
- Energi Dalam Gas Ideal
Energi dalam suatu gas ideal adalah jumlah energi kinetik translasi, rotasi dan vibrasi seluruh molekul gas yang terdapat di dalam suatu wadah tertentu.
Maka energi kinetik rata-rata EK tiap molekul sesuai dengan persamaan berikut.
Dengan f adalah derajat kebebasan molekul gas. Berdasarkan persamaan diatas, dapat ditulis rumus energi dalam gas berdasarkan derajat kebebasannya, sebagai berikut:
- Gas monoatomik (F = 3) , contohnya: He, Ne, Ar
- Gas diatomik seperti H2, N2, dan O2
-Pada suhu rendah (± 250 K) : f =3
-Pada suhu sedang (±500 K) : f = 5

-Pada suhu tinggi (±1000 K) : f=7
Hubungan Gas Ideal dengan Ilmu Kimia
Gas merupakan satu dari tiga wujud zat yang tak terpisahkan dari studi kimia yang memiliki hubungan antara volume, temperatur dan tekanan baik dalam gas ideal maupun dalam gas nyata. Sifat fisik gas bergantung pada struktur molekul gasnya dan sifat kimia gas juga bergantung pada strukturnya. Perilaku gas yang ada sebagai molekul tunggal adalah contoh yang baik kebergantungan sifat makroskopik pada struktur mikroskopik. Contoh gas ideal dalam ilmu kimia adalah gas CO2 (karbon dioksida), NO2 (nitrogen dioksidsa) , C2H2 (asetilena), H2S (asam sulfida) dan lain-lain. Namun pada kenyataannya gas ideal itu tidak ada, tetapi terdapat gas-gas yang hampir menyerupai gas ideal yang disebut degan gas nyata. Contoh gas nyata dalam ilmu kimia adalah gas oksigen (O2), nitrogen (N2), hidrogen (H2), helium (He), neon (Ne) dan lain-lain.
Dalam Ilmu kimia, gas ideal dapat dicirikan oleh tiga variabel keadaan yaitu tekanan mutlak (P), volume (V), dan suhu mutlak (T) dan hubungan diantaranya di rumuskan seperti berikut:
PV = nRT = NkT
Dengan:
n = banyaknya mol
R = Universal gas konstan = 8,3145 J / mol K
N = jumlah molekul
k = konstanta Boltzmann = 1,38066 x 10-23 J / K = 8,617385 x 10-5 eV / K
k = R / NA
NA = Avogadro nomor = 6.0221 x 1023 / mol
Dapat diketahui dari rumus di atas bahwa tekanan berbanding lurus dengan suhu, artinya bahwa setiap suhu di naikkan maka otomatis tekana akan mingkat. Tekanan berbandung terbalik dengan volume, artinnya setiap benda yang volumenya di perbesar maka tekanananya akan semakin mengecil. Sebeliknya bila volume di perkecil menyebabkan tekanan semakin besar. Tekanan berbanding lurus dengan jumlah mol, artinya bila jumlah mol suatu zat di tambakan dalam suatu wadah yang volumenya tetap dapat meningkatkan tekanan di dalam wadah tersebut.
Fenomena Terkait Gas Ideal
- Kantong Udara (Air Bag)
Sumber : imagegoogle
Air Bag adalah perangkat keamanan yang terdiri dari sebuah tas kain besar yang berisi udara. Persamaan gas ideal menjadi pedoman dalam perancangan kantong udara pengaman yang sekarang banyak digunakan pada mobil-mobil sedan. Mengapa diperlukannya kantong udara pada mobil? Kantong udara diperlukan untuk memberikan perlindungan bagi kepala dan tubuh bagian atas pengemudi selama tabrakan. Kapan mengembangnya kantong udara? Kantong udara mengembang saat mobil bertabrakan, hal ini bertujuan untuk memberikan bantalan yang akan mengurangi akibat fatal benturan antara dada dan batang setir. Bagaimana proses mengembangnya kantong udara? Saat kantung udara akan menggelembung, sebuah sinyal dikirim ke unit inflator dalam airbag control unit. Sebuah igniter atau pemanas, memanaskan sebuah reaksi kimia yang sangat cepat dan menghasilkan gas nitrogen (N2) untuk mengisi airbag dan membuatnya menggelembung menerobos cover dari modul airbag. Konsep apa yang ada pada kantong udara tersebut? Konsep yang digunakan pada kantong udara tersebut adalah persamaan gas ideal dengan rumus .
.
2. Balon Gas
sumber: imagegoogle
Banyak gas seperti nitrogen, oksigen, hidrogen, gas mulia dan karbon dioksida dapat diperlakukan seperti gas ideal dengan perbedaan yang masih dapat ditolerir. Namun tidak semua dari gas tersebut dapat membuat balon dapat terbang bebas di udara. Bagaimana cara agar balon dapat naik ke atas? Agar balon gas dapat naik ke atas, biasanya balon diisi dengan gas yang memiliki massa paling ringan di udara. Gas apa saja yang dapat membuat balon terbang di udara? Gas yang dapat membuat balon terbang bebas di udara adalah gas yang memiliki massa jenis atom yang lebih kecil seperti gas hidrogen (H) dan gas helium (He). Walaupun hidrogen dapat membuat balon terbang tinggi, tetapi gas ini sangat berbahaya karena mudah terbakar, sehingga penggunaannya digantikan oleh gas lain yaitu gas helium. Helium termasuk dalam golongan gas mulia, yaitu gas yang paling stabil dan tidak mudah bereaksi. Ini berarti gas helium tidak mudah terbakar seperti gas hidrogen. Inilah yang menjadikan balon helium pilihan terbaik sebagai pengganti balon hidrogen.
CONTOH SOAL
- Satu mol gas berada dalam tabung yang volumenya 50 liter. Bila suhu
gas itu 2270C, berapa tekanan gas ?
Penyelesaian:
Diketahui: n = 1 mol
V = 50 liter = 50 dm3 = 50 x 10-3 m3 = 5 x 10-2 m3
R = 8,31 x 103 J/kmol . K
T = 2270C = (227 + 273) K = 500 K
- Berapa volume 5 gram gas oksigen O2 yang berat molekulnya M = 32 kg/kmol pada keadaan normal (t = 00C dan p= 1 atm) ?
Penyelesaian :
m= 5 gram = 5 x 10-3 kg
M= 32 kg/kmol
T= (0 + 273) = 273 K
p= 1 atm = 105 N/m2
R= 8314 J/kmol.K (kita pilih nilai Rsesuai dengan satuan M dan m)
- Tentukan energi kinetik rata-rata 5 mol gas neon yang volumenya 23 liter dengan tekanan 100 kPa !
Penyelesaian:
n= 5 mol
No= bilangan Avogadro = 6,02 x 1023 partikel/mol
N= 5 . (6,02 x 1023) = 3,01 x 1024 partikel
V= 25 liter x 10-3 m3
p= 100 k Pa = 100 x 103 Pa
- Tentukan energi kinetik rata-rata partikel gas yang memiliki suhu 570C!
Penyelesaian :
T= (57 + 273) K = 330 K
k= 1,38 x 10-23J/K
5. Perhatikan soal berikut ini!